- ऊष्मप्रवैगिकी के नियम क्या हैं?
- ऊष्मप्रवैगिकी के नियमों की उत्पत्ति
- ऊष्मप्रवैगिकी का पहला नियम
- ऊष्मप्रवैगिकी का दूसरा नियम
- ऊष्मप्रवैगिकी का तीसरा नियम
- ऊष्मप्रवैगिकी का शून्य नियम
हम बताते हैं कि ऊष्मप्रवैगिकी के नियम क्या हैं, इन सिद्धांतों की उत्पत्ति क्या है और प्रत्येक की मुख्य विशेषताएं क्या हैं।

ऊष्मप्रवैगिकी के नियम क्या हैं?
ऊष्मप्रवैगिकी के नियम (या उष्मागतिकी के सिद्धांत) तीन मूलभूत भौतिक मात्राओं के व्यवहार का वर्णन करते हैं, तापमान, द ऊर्जा और यहएन्ट्रापी, जो थर्मोडायनामिक सिस्टम की विशेषता है। शब्द "ऊष्मप्रवैगिकी" ग्रीक से आया है थरमस, इसका क्या मतलब है "गर्मी", यू डायनेमो, इसका क्या मतलब है "बल”.
गणितीय रूप से, इन सिद्धांतों का वर्णन a . द्वारा किया गया है सेट अध्ययन के किसी भी वस्तु के रूप में परिभाषित थर्मोडायनामिक प्रणालियों के व्यवहार की व्याख्या करने वाले समीकरणों के (ए . से) अणु या ए मनुष्य, जब तक वायुमंडल या एक सॉस पैन में उबलते पानी)।
ऊष्मप्रवैगिकी के चार नियम हैं और वे . के भौतिक नियमों को समझने के लिए महत्वपूर्ण हैं ब्रम्हांड और कुछ घटनाओं की असंभवता जैसे कि गति लगातार।
ऊष्मप्रवैगिकी के नियमों की उत्पत्ति
के चार सिद्धांत ऊष्मप्रवैगिकी उनके अलग-अलग मूल हैं, और कुछ पिछले वाले से तैयार किए गए थे। सबसे पहले स्थापित किया गया, वास्तव में, दूसरा था, 1824 में फ्रांसीसी भौतिक विज्ञानी और इंजीनियर निकोलस लियोनार्ड साडी कार्नोट का काम।
हालाँकि, 1860 में इस सिद्धांत को रुडोल्फ क्लॉज़ियस और विलियम थॉम्पसन द्वारा फिर से तैयार किया गया था, फिर जिसे हम अब थर्मोडायनामिक्स का पहला नियम कहते हैं, को जोड़ते हैं। बाद में तीसरा दिखाई दिया, जिसे "नेर्स्ट पोस्टुलेट" के रूप में भी जाना जाता है क्योंकि यह 1906 और 1912 के बीच वाल्थर नर्नस्ट के अध्ययन के लिए धन्यवाद उत्पन्न हुआ।
अंत में, तथाकथित "शून्य कानून" 1930 में सामने आया, जिसे गुगेनहाइम और फाउलर द्वारा प्रस्तावित किया गया था। यह कहा जाना चाहिए कि सभी क्षेत्रों में इसे एक सच्चे कानून के रूप में मान्यता प्राप्त नहीं है।
ऊष्मप्रवैगिकी का पहला नियम

पहले कानून को "ऊर्जा के संरक्षण का कानून" कहा जाता है क्योंकि यह तय करता है कि किसी में भी प्रणाली अपने पर्यावरण से पृथक, ऊर्जा की कुल मात्रा हमेशा समान रहेगी, भले ही इसे ऊर्जा के एक रूप से भिन्न रूप में परिवर्तित किया जा सकता है। या दूसरे शब्दों में: ऊर्जा को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है, केवल रूपांतरित किया जा सकता है।
इस प्रकार, एक भौतिक प्रणाली को दी गई मात्रा में गर्मी (क्यू) की आपूर्ति करके, इसकी कुल ऊर्जा की मात्रा की गणना की जा सकती है क्योंकि गर्मी की आपूर्ति की गई हैकाम (डब्ल्यू) सिस्टम द्वारा अपने परिवेश पर किया जाता है। एक सूत्र में व्यक्त किया गया: ΔU = Q - W।
इस नियम के एक उदाहरण के रूप में, आइए एक हवाई जहाज के इंजन की कल्पना करें। यह एक थर्मोडायनामिक प्रणाली है जिसमें ईंधन होता है जो की प्रक्रिया के दौरान रासायनिक रूप से प्रतिक्रिया करता है दहन, गर्मी छोड़ता है और काम करता है (जिससे विमान चलता है)। इसलिए: यदि हम किए गए कार्य और जारी की गई गर्मी की मात्रा को माप सकते हैं, तो हम सिस्टम की कुल ऊर्जा की गणना कर सकते हैं और यह निष्कर्ष निकाल सकते हैं कि उड़ान के दौरान इंजन में ऊर्जा स्थिर रही: ऊर्जा न तो बनाई गई और न ही नष्ट हुई, बल्कि इसे बदल दिया गया। का रासायनिक ऊर्जा प्रति कैलोरी ऊर्जा यूगतिज ऊर्जा (आंदोलन, यानी काम)।
ऊष्मप्रवैगिकी का दूसरा नियम
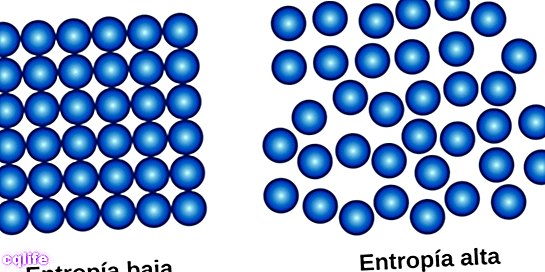
दूसरा नियम, जिसे "एन्ट्रॉपी का नियम" भी कहा जाता है, को संक्षेप में इस बात में संक्षेपित किया जा सकता है कि की मात्रा एन्ट्रापी ब्रह्मांड में में वृद्धि करने के लिए जाता है मौसम. इसका मतलब यह है कि सिस्टम के विकार की डिग्री संतुलन के एक बिंदु तक पहुंचने तक बढ़ जाती है, जो कि सिस्टम के सबसे बड़े विकार की स्थिति है।
यह कानून भौतिकी में एक मौलिक अवधारणा का परिचय देता है: एन्ट्रॉपी की अवधारणा (अक्षर एस द्वारा दर्शाया गया), जो भौतिक प्रणालियों के मामले में विकार की डिग्री का प्रतिनिधित्व करता है। यह पता चला है कि प्रत्येक भौतिक प्रक्रिया में जिसमें ऊर्जा का परिवर्तन होता है, एक निश्चित मात्रा में ऊर्जा उपयोग करने योग्य नहीं होती है, अर्थात यह काम नहीं कर सकती है। यदि आप काम नहीं कर सकते हैं, तो ज्यादातर मामलों में वह ऊर्जा गर्मी है। वह गर्मी जो सिस्टम जारी करता है, वह जो करता है वह सिस्टम के विकार को बढ़ाता है, इसकी एन्ट्रॉपी। एन्ट्रॉपी एक प्रणाली के विकार का एक उपाय है।
इस कानून का निर्माण यह स्थापित करता है कि एन्ट्रापी (डीएस) में परिवर्तन हमेशा बराबर या उससे अधिक होगागर्मी का हस्तांतरण (डीक्यू), सिस्टम के तापमान (टी) से विभाजित। यानी: डीएस डीक्यू / टी।
इसे एक उदाहरण से समझने के लिए, यह एक निश्चित मात्रा में जलाने के लिए पर्याप्त है मामला और फिर परिणामी राख को इकट्ठा करें। जब उनका वजन किया जाता है, तो हम यह सत्यापित करेंगे कि यह अपनी प्रारंभिक अवस्था की तुलना में कम है: पदार्थ का एक हिस्सा गर्मी में परिवर्तित हो गया था गैसों कि वे सिस्टम पर काम नहीं कर सकते हैं और वे इसके विकार में योगदान करते हैं।
ऊष्मप्रवैगिकी का तीसरा नियम

तीसरा नियम कहता है कि एक प्रणाली की एन्ट्रापी जिसे पूर्ण शून्य पर लाया जाता है, एक निश्चित स्थिरांक होगी। दूसरे शब्दों में:
- निरपेक्ष शून्य (केल्विन इकाइयों में शून्य) तक पहुँचने पर, भौतिक प्रणालियों की प्रक्रियाएँ रुक जाती हैं।
- निरपेक्ष शून्य (केल्विन इकाइयों में शून्य) तक पहुँचने पर, एन्ट्रापी का एक स्थिर न्यूनतम मान होता है।
तथाकथित निरपेक्ष शून्य (-273.15 डिग्री सेल्सियस) तक दैनिक आधार पर पहुंचना मुश्किल है, लेकिन फ्रीजर में क्या होता है इसका विश्लेषण करके हम इस कानून के बारे में सोच सकते हैं: खाना जो हम जमा करते हैं वह इतनी ठंडी हो जाएगी कि उसके अंदर की जैव रासायनिक प्रक्रिया धीमी हो जाएगी या रुक भी जाएगी। इसलिए इसके अपघटन में देरी हो रही है और इसका उपभोग बहुत अधिक समय तक।
ऊष्मप्रवैगिकी का शून्य नियम
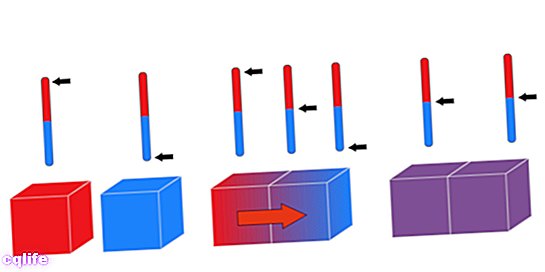
"शून्य कानून" उस नाम से जाना जाता है, हालांकि यह चलने वाला आखिरी था। के रूप में भी जाना जाता है ऊष्मीय संतुलन का नियम, यह सिद्धांत बताता है कि: "यदि दो प्रणालियाँ अंदर हैं थर्मल संतुलन स्वतंत्र रूप से एक तीसरी प्रणाली के साथ, उन्हें एक दूसरे के साथ थर्मल संतुलन में भी होना चाहिए ”। इसे तार्किक रूप से निम्नानुसार व्यक्त किया जा सकता है: यदि ए = सी और बी = सी, तो ए = बी।
यह कानून हमें तीन अलग-अलग निकायों ए, बी और सी की थर्मल ऊर्जा की तुलना करने की अनुमति देता है। यदि शरीर ए शरीर सी के साथ थर्मल संतुलन में है (उनका तापमान समान है) और बी का भी सी के समान तापमान है, तो ए और B का तापमान समान है।
इस सिद्धांत को बताने का एक अन्य तरीका यह तर्क देना है कि जब अलग-अलग तापमान वाले दो शरीर संपर्क में आते हैं, तो वे तब तक गर्मी का आदान-प्रदान करते हैं जब तक कि उनका तापमान बराबर न हो जाए।
इस कानून के दैनिक उदाहरण आसानी से मिल जाते हैं। जब हम ठंडे या गर्म पानी में जाते हैं, तो हमें तापमान में अंतर केवल पहले मिनटों के दौरान ही दिखाई देता है, क्योंकि तब हमारा शरीर तापीय संतुलन में प्रवेश करेगा।पानी और हम अब अंतर को नोटिस नहीं करेंगे। ऐसा ही होता है जब हम गर्म या ठंडे कमरे में प्रवेश करते हैं: हम पहले तापमान को नोटिस करेंगे, लेकिन फिर हम अंतर को समझना बंद कर देंगे क्योंकि हम इसके साथ थर्मल संतुलन में प्रवेश करेंगे।
